Rolul trombocitelor în concentratul de aspirație de măduvă osoasă
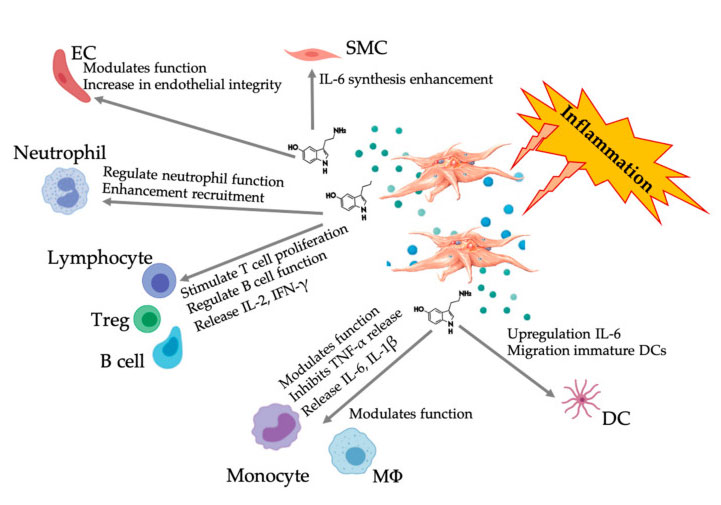
PRP și concentratul de aspirație a măduvei osoase (BMAC) sunt utilizate pentru o serie de tratamente clinice în mediul de birou și chirurgie datorită beneficiilor lor regenerative în MSK și bolile coloanei vertebrale, gestionarea durerii cronice și indicațiile țesuturilor moi.PRP nu numai că reglează migrația și proliferarea celulelor, dar contribuie și la angiogeneză și remodelarea ECM pentru a crea un micromediu favorabil și pentru a promova repararea și regenerarea țesuturilor.
Proces de reparare BMAC
BMAC-urile sunt compoziții celulare eterogene care conțin BMMSC, făcându-le o sursă de celule endogene pentru terapia de reparare a medicinei regenerative.Ele joacă un rol prin reducerea apoptozei celulare, a fibrozei și a inflamației;Și activează reacția în cascadă care duce la proliferarea celulară.În plus, BMMSC-urile au potențialul de a se diferenția într-o varietate de linii celulare, inclusiv osteoblaste, adipocite, mioblaste, celule epiteliale și neuroni.De asemenea, ele promovează angiogeneza prin căi paracrine și autocrine.De asemenea, este important ca BMMSC să contribuie la reglarea imună independent de celulele imune specifice, care participă la stadiul inflamator al reparării rănilor.În plus, BMMSC sprijină recrutarea de celule în noi locuri de tratament pentru angiogeneză pentru a accelera reconstrucția fluxului sanguin local.Jin şi colab.S-a dovedit că, în absența unor schele suficiente, rata de supraviețuire a BMMSC și capacitatea sa de reparare și diferențiere de a promova vindecarea au fost afectate.Deși colectarea de țesuturi, pregătirea specimenelor și mecanismul de acțiune al PRP și BMAC sunt diferite, studiile arată că se pot completa reciproc.De fapt, combinarea PRP și BMAC într-un produs biologic poate avea avantaje suplimentare.
Combinând PRP și BMAC
Conform unor cercetări puțin cunoscute, principiul de bază al combinării PRP și BMAC se bazează pe mai multe premise.În primul rând, PRP poate oferi un micromediu adecvat în care BMSC poate îmbunătăți proliferarea și diferențierea celulelor și poate crește angiogeneza.În al doilea rând, PRP a fost folosit ca schelă pentru aceste celule împreună cu BMAC.Dimpotrivă, combinația dintre PRP și BMAC poate deveni un instrument biologic puternic pentru a atrage populația BMMSC.Compusul PRP-BMAC a fost utilizat pentru tratarea tendinozei, rănilor, leziunilor măduvei spinării, discurilor intervertebrale degenerative și defecte osteocondrale cu potențial mare de regenerare.Din păcate, deși componentele eterogene ale celulelor măduvei osoase includ trombocite, puține rapoarte menționează concentrația de trombocite în măduva osoasă extrasă și după tratamentul BMAC, dar acestea pot fi extrase prin metode de aspirație adecvate.Sunt necesare cercetări suplimentare pentru a înțelege dacă trebuie utilizate concentrate suplimentare de trombocite în combinație cu BMAC.În prezent, nu există date despre raportul optim dintre trombocite și celulele MSC (sau alte celule ale măduvei osoase), ceea ce are un impact pozitiv asupra mecanismului nutrițional al MSC în repararea țesuturilor.În mod ideal, echipamentele și tehnologia de colectare a măduvei osoase pot fi optimizate pentru a extrage suficiente trombocite din măduva osoasă.
Factorul de creștere PRP și efectul nutrițional BMAC
Factorul de creștere a trombocitelor PRP este o proteină cheie implicată în procesul de reparare a BMAC.Diversitatea PGF și a altor citokine implicate în procesul nutrițional al BMAC poate iniția repararea țesuturilor prin reducerea apoptozei celulare, a anabolismului și a efectelor antiinflamatorii și prin activarea proliferării, diferențierii și angiogenezei celulare prin căile paracrine și autocrine.
Factorul de creștere derivat din trombocite și componentele granulelor dense sunt în mod evident implicate în procesul nutrițional al BMAC și sprijină repararea și regenerarea țesuturilor induse de MSC.Abrevieri: MSC: celule stem mezenchimale, HSC: celule stem hematopoietice.
Evident, în tratamentul OA, PDGF joacă un rol specific în regenerarea cartilajului și menținerea homeostaziei prin proliferarea MSC și inhibarea apoptozei și inflamației condrocitelor induse de IL-1.În plus, trei subtipuri de TGF-β sunt active în stimularea formării cartilajului și inhibarea inflamației și arată capacitatea de a promova vindecarea țesuturilor legate de MSC prin interacțiunea intermoleculară.Efectul nutrițional al MSC este legat de activitatea PGF și de secreția de citokine reparatoare.În mod ideal, toate aceste citokine ar trebui să fie prezente în sticla de tratament BMAC și transportate la locul leziunii tisulare pentru a promova cea mai bună vindecare terapeutică a țesutului legat de MSC.
Într-un studiu comun OA, Mui ñ os-L ó pez și colab.Acesta arată că MSC derivat din țesutul sinovial și-a schimbat funcția, ducând la pierderea capacității sale de recuperare.Interesant este că injectarea directă de PRP în osul subcondral al osteoartritei a dus la reducerea MSC în lichidul sinovial, indicând o îmbunătățire clinică.Efectul terapeutic este mediat de reducerea procesului inflamator din lichidul sinovial al pacienților cu OA.
Există puține informații disponibile despre prezența sau concentrația PGF în BMAC sau raportul ideal necesar pentru a susține funcția nutrițională a BMMSC.Unii clinicieni combină concentrația mare de PRP cu BMAC pentru a obține mai multe grefe biologic active, ceea ce este de așteptat să optimizeze rezultatele tratamentului medicinei regenerative.Cu toate acestea, există puține date de siguranță și eficacitate disponibile, care indică faptul că combinarea concentrației mari de PRP cu BMAC este o opțiune de tratament mai eficientă.Prin urmare, credem că ar putea să nu fie adecvat să manipulăm BMMSC prin activarea lor cu concentrație mare de trombocite în această etapă.
Interacțiunea trombocitelor cu medicamentele antiplachetare și AINS
PRP conține un spectru larg de componente secretoare și este compus din multe medii biologice.Efectul terapeutic al PRP este atribuit acestor mediatori.Deși mediatorii terapeutici din trombocite sunt bine cunoscuți, formularea optimă și cinetica acestor medicamente anabolice și catabolice nu sunt complet clare.Una dintre principalele limitări ale realizării formulărilor terapeutice este de a depăși variabilitatea acestor mediatori biologici pentru a viza efectele din aval bine reglate, care sunt întotdeauna repetabile și benefice clinic.Din acest motiv, medicamentele (cum ar fi antiinflamatoarele nesteroidiene (AINS)) pot afecta eliberarea grupelor secretoare de trombocite.Într-un studiu recent deschis, cu secvență fixă, aportul zilnic de 81 mg de aspirină (ASA) a redus expresia mediatorilor cheie, cum ar fi TGF-β1. PDGF și VEGF.
Aceste efecte sunt atribuite inhibării ireversibile a ciclooxigenazei-1 (COX-1) și inhibării reglabile a ciclooxigenazei-2 (COX-2), care sunt două enzime necesare pentru degranularea trombocitelor în aval.O revizuire sistematică recentă a constatat că medicamentele antiplachetare pot reduce curba de eliberare a factorului de creștere într-o manieră dependentă de COX-1 și COX-2, iar 8 din cele 15 studii au constatat că factorii de creștere au scăzut.
Medicamentele (de exemplu, AINS) sunt utilizate de obicei pentru a calma durerea și pentru a reduce inflamația cauzată de boala MSK.Mecanismul AINS este de a inhiba activarea trombocitelor prin legarea ireversibilă de enzima COX și reglarea căii acidului arahidonic.Prin urmare, funcția trombocitelor se va schimba pe parcursul întregului ciclu de viață al trombocitelor, prevenind astfel transmiterea semnalului PGF.AINS inhibă producția de citokine (de exemplu, PDGF, FGF, VEGF și IL-1 β, IL-6 și IL-8), în timp ce sporesc TNF-α。 Cu toate acestea, există puține date despre impactul molecular al AINS asupra PRP.Nu există un consens cu privire la cel mai bun moment pentru prepararea și administrarea PRP la pacienții care utilizează AINS.Mannava și colegii săi au cuantificat factorii biologici anabolici și catabolici din PRP bogat în leucocite ale voluntarilor sănătoși care au luat naproxen.Ei au descoperit că, după utilizarea naproxenului timp de o săptămână, nivelurile de PDGF-AA și PDGF-AB (mitogen eficient pentru promovarea angiogenezei) au fost reduse semnificativ.După o săptămână, nivelul factorului de creștere a revenit aproape de nivelul de bază.După utilizarea naproxenului timp de o săptămână, nivelul LR-PRP al factorului proinflamator și catabolic IL-6 a scăzut, de asemenea, și a revenit la nivelul inițial după o perioadă de eliminare de o săptămână.În prezent, nu există un studiu clinic care să demonstreze că pacienții cu naproxen după tratamentul cu PRP au rezultate negative;Cu toate acestea, se recomandă să se ia în considerare o perioadă de spălare de o săptămână pentru a restabili valorile PDGF-AA, PDGF-BB și IL-6 la nivelul de referință pentru a îmbunătăți activitatea lor biologică.Sunt necesare mai multe cercetări pentru a înțelege pe deplin efectele antiplachetare și AINS asupra grupului de secreție de PRP și țintele sale din aval.
Combinați aplicarea plasmei bogate în trombocite cu reabilitarea
Deși cercetările științifice de bază arată că kinetoterapie și încărcarea mecanică au un rol clar în recuperarea structurii tendonului după injectarea PRP, nu există un consens cu privire la cel mai bun plan de reabilitare pentru boala MSK după tratamentul cu PRP.
Tratamentul cu PRP include injectarea de trombocite concentrate în mediul local de țesut pentru a regla durerea și a promova repararea țesuturilor.Cele mai puternice dovezi clinice există în OA la genunchi.Cu toate acestea, utilizarea PRP în tratamentul tendinozei simptomatice este controversată, iar rezultatele raportate sunt diferite.Studiile la animale arată de obicei o îmbunătățire histologică a tendinozei după infiltrarea PRP.Aceste studii arată că sarcina mecanică poate regenera tendoanele, iar sarcina și injecția PRP lucrează împreună pentru a promova vindecarea tendonului.Diferențele dintre preparatele PRP, preparatele biologice, preparatele, schemele de injecție și subtipurile de leziuni ale tendonului pot duce la diferențe în rezultatele clinice.În plus, deși dovezile științifice susțin beneficiile planurilor de reabilitare, puține investigații clinice publicate încearcă să gestioneze și să integreze planuri consistente de reabilitare post-PRP.
Recent, Onishi et al.A fost revizuit rolul sarcinii mecanice și al efectului biologic al PRP în boala tendonului lui Ahile.Ei au evaluat studiile clinice de fază I și faza II ale bolii tendonului lui Ahile tratate cu PRP, concentrându-se pe planul de reabilitare după injectarea PRP.Programele de reabilitare supravegheate par să îmbunătățească respectarea efortului și să îmbunătățească rezultatele și capacitatea de a monitoriza doza de efort.Mai multe studii PRP bine concepute pentru tendonul lui Ahile au combinat tratamentul post-PRP cu planul de reabilitare a sarcinii mecanice ca parte integrantă a strategiei de regenerare.
Perspective de viitor și concluzii
Progresul tehnic al echipamentelor PRP și metodelor de preparare arată rezultate promițătoare pentru pacienți, deși definiția diferiților agenți biologici PRP și caracteristicile biologice relevante ale produsului final sunt încă neconcludente.În plus, nu a fost determinat întregul potențial al indicațiilor și aplicațiilor PRP.Până de curând, PRP a fost vândut comercial ca un produs derivat din sânge autolog, care poate oferi medicilor capacitatea de a utiliza tehnologia factorului de creștere a trombocitelor autolog în patologia și bolile specifice indicate.La început, singurul criteriu pentru aplicarea cu succes a PRP care este adesea citat este proba pregătită, a cărei concentrație de trombocite este mai mare decât valoarea totală a sângelui.Astăzi, din fericire, practicienii au o înțelegere mai cuprinzătoare a funcționării PRP.
În această revizuire, recunoaștem că există încă o lipsă de standardizare și clasificare în tehnologia de preparare;Prin urmare, nu există un consens cu privire la agenții biologici PRP în prezent, deși mai multe literaturi au ajuns la un acord asupra concentrației efective a dozei de trombocite necesare pentru a promova (noua) angiogeneză.Aici, am introdus pe scurt activitatea PGF-urilor, dar am reflectat mai larg mecanismul plachetar specific și efectul efector al celulelor albe din sânge și MSC-urilor, precum și interacțiunea ulterioară celulă-celulă.În special, prezența celulelor albe din sânge în preparatele PRP oferă o înțelegere mai profundă a efectelor nocive sau benefice.S-a discutat despre rolul clar al trombocitelor și interacțiunea lor cu sistemele imunitare înnăscute și adaptative.În plus, sunt necesare studii clinice suficiente și bine documentate pentru a determina întregul potențial și efectul terapeutic al PRP în diferite indicații.
(Conținutul acestui articol este retipărit și nu oferim nicio garanție expresă sau implicită pentru acuratețea, fiabilitatea sau completitudinea conținutului conținutului acestui articol și nu suntem responsabili pentru opiniile acestui articol, vă rugăm să înțelegeți.)
Ora postării: Mar-01-2023