PRP modern: „PRP clinic”
În ultimii 10 ani, schema de tratament a PRP a suferit mari schimbări.Prin cercetări experimentale și clinice, acum avem o mai bună înțelegere a fiziologiei trombocitelor și a altor celule.În plus, mai multe evaluări sistematice de înaltă calitate, meta-analize și studii randomizate controlate au arătat eficacitatea biotehnologiei PRP în multe domenii medicale, inclusiv dermatologie, chirurgie cardiacă, chirurgie plastică, chirurgie ortopedică, managementul durerii, boli ale coloanei vertebrale și medicina sportivă. .
Caracteristica actuală a PRP este concentrația sa absolută de trombocite, care se schimbă de la definiția inițială a PRP (inclusiv concentrația de trombocite mai mare decât valoarea de referință) la mai mult de 1 × 10 6/µ L sau de aproximativ 5 ori concentrația minimă de trombocite în trombocite din de bază.În revizuirea extensivă a lui Fadadu și colab.Au fost evaluate 33 de sisteme și protocoale PRP.Numărul de trombocite din preparatul final de PRP produs de unele dintre aceste sisteme este mai mic decât cel al întregului sânge.Ei au raportat că factorul trombocitar al PRP a crescut până la 0,52 cu trusa de spin unic (Selphyl®).În schimb, EmCyte Genesis PurePRPII® cu rotație dublă Concentrația de trombocite produsă de dispozitiv este cea mai mare (1,6 × 10 6 /µL).
Evident, metodele in vitro și animale nu sunt mediul de cercetare ideal pentru transformarea cu succes în practică clinică.În mod similar, studiul de comparare a dispozitivelor nu susține decizia, deoarece acestea arată că concentrația de trombocite între dispozitivele PRP este foarte diferită.Din fericire, prin tehnologia și analizele bazate pe proteomică, ne putem îmbunătăți înțelegerea funcțiilor celulare din PRP care afectează rezultatele tratamentului.Înainte de a ajunge la un consens asupra preparatelor și formulărilor standardizate de PRP, PRP ar trebui să urmeze formulările clinice de PRP pentru a promova mecanisme substanțiale de reparare a țesuturilor și rezultate clinice progresive.
Formula clinica PRP
În prezent, PRP clinic eficient (C-PRP) a fost caracterizat ca o compoziție complexă de componente multicelulare autologe în plasmă de volum mic, obținută dintr-o parte a sângelui periferic după centrifugare.După centrifugare, PRP și componentele sale celulare non-plachetare pot fi recuperate din dispozitivul de concentrare în funcție de diferite densități celulare (dintre care densitatea trombocitară este cea mai mică).
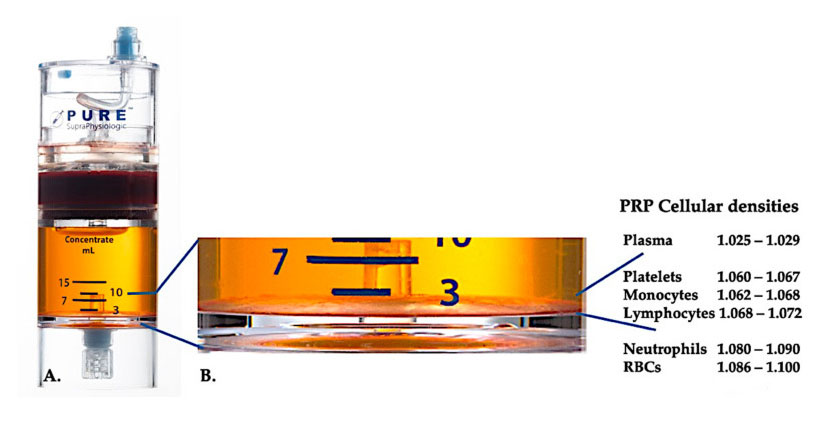
Utilizare Echipamentul de separare a densității celulare PurePRP-SP ® (EmCyte Corporation, Fort Myers, FL, SUA) a fost utilizat pentru sânge integral după două proceduri de centrifugare.După primul proces de centrifugare, întreaga componentă a sângelui a fost separată în două straturi de bază, suspensie de plasmă de trombocite (slabă) și stratul de globule roșii.În A, a doua etapă de centrifugare a fost finalizată.Volumul real de PRP poate fi extras pentru aplicarea pacientului.Mărirea în B arată că în partea de jos a echipamentului există un strat de sedimentare eritrocitară multicomponentă organizată (reprezentat prin linie albastră), care conține concentrații mari de trombocite, monocite și limfocite, pe baza gradientului de densitate.În acest exemplu, conform protocolului de preparare C-PRP cu neutrofile sărace, se va extrage procentul minim de neutrofile (<0,3%) și eritrocite (<0,1%).
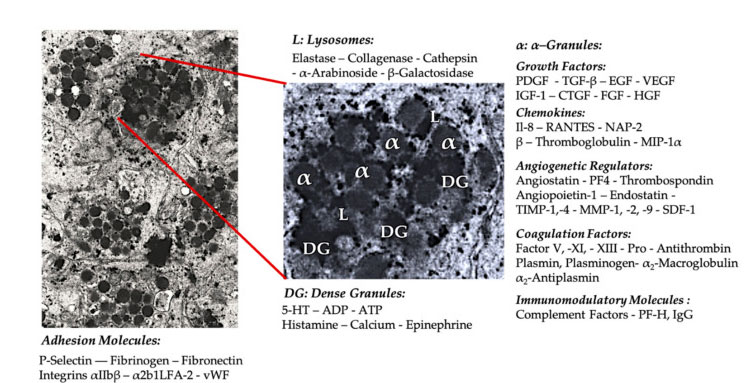
Granule trombocite
În aplicarea clinică timpurie a PRP, α- Granulele sunt structura internă a trombocitelor cel mai frecvent citată, deoarece conțin factori de coagulare, un număr mare de PDGF și regulatori angiogeni, dar au o funcție trombogenă redusă.Alți factori includ componente mai puțin cunoscute de chemokine și citokine, cum ar fi factorul plachetar 4 (PF4), proteina de bază pre-trombocitară, P-selectina (un activator al integrinei) și chemokinele RANTES (reglate prin activare, care exprimă celulele T normale și, probabil, secretare).Funcția generală a acestor componente specifice granulelor plachetare este de a recruta și activa alte celule imunitare sau de a induce inflamația celulelor endoteliale.
Componentele granulare dense precum ADP, serotonina, polifosfatul, histamina si adrenalina sunt folosite mai implicit ca regulatori ai activarii trombocitelor si trombozei.Cel mai important, multe dintre aceste elemente au funcția de a modifica celulele imune.ADP plachetar este recunoscut de receptorul P2Y12ADP de pe celulele dendritice (DC), crescând astfel endocitoza antigenului.DC (celula prezentatoare de antigen) este foarte importantă pentru inițierea răspunsului imun al celulelor T și controlul răspunsului imunitar protector, care leagă sistemul imunitar înnăscut și sistemul imunitar adaptativ.În plus, trombocitul adenozin trifosfat (ATP) trimite semnale prin receptorul celulelor T P2X7, ceea ce duce la diferențierea crescută a celulelor CD4 T helper în celule T helper 17 (Th17) proinflamatorii.Alte componente granulare dense de trombocite (cum ar fi glutamatul și serotonina) induc migrarea celulelor T și, respectiv, cresc diferențierea monocitelor la DC.În PRP, acești imunomodulatori derivați din particule dense sunt foarte îmbogățiți și au funcții imune substanțiale.
Numărul de interacțiuni potențiale directe și indirecte dintre trombocite și alte celule (receptoare) este extins.Prin urmare, aplicarea PRP în mediul local de țesut patologic poate induce o varietate de efecte inflamatorii.
Concentrația trombocitelor
C-PRP ar trebui să conțină doze clinice de trombocite concentrate pentru a produce efecte terapeutice benefice.Trombocitele din C-PRP ar trebui să stimuleze proliferarea celulară, sinteza factorilor mezenchimali și neurotrofici, să promoveze migrarea celulelor chemotactice și să stimuleze activitatea imunoreglatoare, așa cum se arată în figură.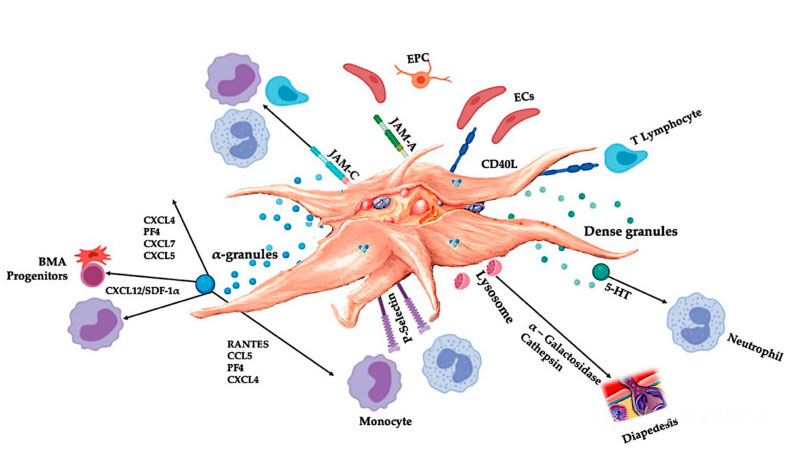
Trombocitele activate, eliberarea de PGF și moleculele de adeziune mediază o varietate de interacțiuni celulare: chimiotaxie, aderență celulară, migrare și diferențiere celulară și reglează activitățile de reglare imună.Aceste interacțiuni celule-celule plachetare contribuie la angiogeneză și activitatea inflamatorie și, în cele din urmă, stimulează procesul de reparare a țesuturilor.Abrevieri: BMA: aspirat de măduvă osoasă, EPC: celule progenitoare endoteliale, EC: celule endoteliale, 5-HT: 5-hidroxitriptamina, RANTES: reglarea activată a expresiei normale a celulelor T și a secreției presupuse, JAM: tip moleculă de adeziune a joncțiunii, CD40L: cluster 40 ligand, SDF-1 α: factor-1 α derivat din celulele stromale, CXCL: ligand chemokine (motiv CXC), PF4: factor plachetar 4. Adaptat de la Everts et al.
Marx a fost prima persoană care a dovedit că vindecarea osului și a țesuturilor moi a fost îmbunătățită, iar numărul minim de trombocite a fost de 1 × 10 6 /µL。 Aceste rezultate au fost confirmate într-un studiu al fuziunii lombare prin foramenul intervertebral, când doza de trombocite a fost mai mare decât 1,3 × La 106 trombocite/µL, acest studiu a demonstrat mai multă fuziune.În plus, Giusti et al.Dezvăluit 1,5 × Mecanismul de reparare a țesuturilor la o doză de 109 necesită trombocite/mL pentru a induce angiogeneza funcțională prin activitatea celulelor endoteliale.În ultimul studiu, concentrațiile mai mari au redus potențialul de angiogeneză al trombocitelor în și în jurul foliculilor.În plus, datele anterioare au arătat că doza de PRP ar afecta și rezultatele tratamentului.Prin urmare, pentru a induce în mod semnificativ reacția de angiogeneză și pentru a stimula proliferarea și migrarea celulelor, C-PRP ar trebui să conțină cel puțin 7,5 într-o sticlă de tratament cu PRP de 5 ml × 10 9 pot livra trombocite.
În plus față de dependența de doză, efectul PRP asupra activității celulelor pare să fie foarte dependent de timp.Sophie et al.Aceste rezultate sugerează că expunerea pe termen scurt la lizatele trombocitelor umane poate stimula proliferarea celulelor osoase și chimiotaxia.Dimpotrivă, expunerea pe termen lung la PRP va duce la niveluri mai scăzute de fosfatază alcalină și formare de minerale.
Globule roșii
Globulele roșii sunt responsabile pentru transportul oxigenului către țesuturi și transferul dioxidului de carbon din țesuturi la plămâni.Nu au nucleu și sunt compuse din molecule hem care se leagă de proteine.Componentele fierului și hemului din celulele roșii din sânge promovează combinația de oxigen și dioxid de carbon.În general, ciclul de viață al celulelor roșii din sânge este de aproximativ 120 de zile.Ele sunt îndepărtate din circulație de către macrofage printr-un proces numit îmbătrânire RBC.Celulele roșii din probele de PRP pot fi deteriorate în condiții de forfecare (de exemplu, intervenție chirurgicală de sângerare totală, proces mediat imun, stres oxidativ sau schemă inadecvată de concentrație a PRP).Prin urmare, membrana celulelor RBC se descompune și eliberează hemoglobina toxică (Hb), măsurată prin hemoglobină liberă din plasmă (PFH), hem și fier.].PFH și produșii săi de degradare (hem și fier) conduc împreună la efecte nocive și citotoxice asupra țesuturilor, ducând la stres oxidativ, pierderea oxidului nitric, activarea căilor inflamatorii și imunosupresie.Aceste efecte vor duce în cele din urmă la disfuncția microcirculației, vasoconstricție locală și leziuni vasculare, precum și leziuni tisulare grave.
Cel mai important lucru este că atunci când RBC care conține C-PRP este livrat în țesut, va provoca o reacție locală numită eriptoză, care va declanșa eliberarea unui inhibitor eficient al migrației citokinelor și macrofagelor.Această citokină inhibă migrarea monocitelor și macrofagelor.Ea exercită semnale pro-inflamatorii puternice către țesuturile înconjurătoare, inhibă migrarea celulelor stem și proliferarea fibroblastelor și duce la disfuncția celulelor locale semnificative.Prin urmare, este important să se limiteze contaminarea RBC în preparatele PRP.În plus, rolul eritrocitelor în regenerarea țesuturilor nu a fost niciodată determinat.Procesul adecvat de centrifugare și preparare a C-PRP va reduce sau chiar elimina prezența globulelor roșii, evitând astfel consecințele adverse ale hemolizei și policitemiei.
Leucocite în C-PRP
Prezența globulelor albe în preparatele PRP depinde de echipamentul de tratament și schema de preparare.În echipamentele PRP pe bază de plasmă, celulele albe din sânge sunt complet eliminate;Cu toate acestea, celulele albe din sânge au fost concentrate semnificativ în prepararea PRP a stratului maro de sedimentare a eritrocitelor.Datorită mecanismelor sale imunitare și de apărare a gazdei, celulele albe din sânge afectează în mare măsură biologia internă a afecțiunilor acute și cronice ale țesuturilor.Aceste caracteristici vor fi discutate mai jos.Prin urmare, prezența leucocitelor specifice în C-PRP poate provoca efecte celulare și tisulare semnificative.Mai precis, diferite sisteme de sedimentare a eritrocitelor PRP în strat galben-maro utilizează diferite scheme de preparare, producând astfel proporții diferite de neutrofile, limfocite și monocite în PRP.Eozinofilele și bazofilele nu pot fi măsurate în preparatele PRP, deoarece membranele lor celulare sunt prea fragile pentru a rezista forțelor de procesare centrifugă.
Neutrofile
Neutrofilele sunt leucocite esențiale în multe căi de vindecare.Aceste căi se combină cu proteinele antimicrobiene prezente în trombocite pentru a forma o barieră densă împotriva agenților patogeni invazivi.Existența neutrofilelor este determinată în funcție de ținta de tratament a C-PRP.Niveluri crescute de inflamație a țesuturilor pot fi necesare în bioterapia PRP pentru îngrijirea rănilor cronice sau în aplicații care vizează creșterea sau vindecarea oaselor.Este important că funcțiile neutrofile suplimentare au fost găsite în mai multe modele, subliniind rolul lor în angiogeneză și repararea țesuturilor.Cu toate acestea, neutrofilele pot provoca și efecte nocive, așa că nu sunt potrivite pentru unele aplicații.Zhou și Wang au demonstrat că utilizarea PRP bogat în neutrofile poate duce la o creștere a raportului dintre colagenul de tip III și colagenul de tip I, exacerbând astfel fibroza și reducând rezistența tendonului.Alte caracteristici dăunătoare mediate de neutrofile sunt eliberarea de citokine inflamatorii și metaloproteinaze de matrice (MMP), care pot promova inflamația și catabolismul atunci când sunt aplicate pe țesuturi.
Leucomonocite
În C-PRP, limfocitele mononucleare T și B sunt mai concentrate decât orice alte globule albe din sânge.Ele sunt strâns legate de imunitatea adaptativă citotoxică mediată de celule.Limfocitele pot declanșa reacții celulare pentru a lupta împotriva infecțiilor și a se adapta la invadatori.În plus, citokinele derivate din limfocite T (interferon-γ [IFN-γ] și interleukina-4 (IL-4) îmbunătățesc polarizarea macrofagelor. Verassar și colab. Se dovedește că limfocitele T convenționale pot promova indirect vindecarea țesuturilor în modelul de șoarece prin reglarea diferențierii monocitelor și macrofagelor.
Monocit – celulă de reparare multipotentă
În funcție de dispozitivul de preparare a PRP utilizat, monocitele pot să iasă sau să nu existe în sticla de tratament cu PRP.Din păcate, performanțele și capacitatea lor de regenerare sunt rar discutate în literatură.Prin urmare, se acordă puțină atenție monocitelor în metoda de preparare sau formula finală.Grupul monocitelor este eterogen, provine din celulele progenitoare din măduva osoasă și este transportat către țesuturile periferice prin calea celulelor stem hematopoietice în funcție de stimularea micromediului.În timpul homeostaziei și inflamației, monocitele circulante părăsesc fluxul sanguin și sunt recrutate în țesuturile lezate sau degradate.Ele pot acționa ca macrofage (M Φ) celule efectoare sau celule progenitoare.Monocitele, macrofagele și celulele dendritice reprezintă sistemul fagocitar mononuclear (MPS). O trăsătură tipică a MPS este plasticitatea modelului său de expresie genică și suprapunerea funcțională între aceste tipuri de celule.În țesuturile degenerate, macrofagele rezidente, factorii de creștere care acționează local, citokinele proinflamatorii, celulele apoptotice sau necrotice și produsele microbiene inițiază monocitele să se diferențieze în grupuri de celule MPS.Să presupunem că atunci când C-PRP care conține monocite cu randament ridicat este injectat în micromediul local al bolii, este posibil ca monocitele să se diferențieze în M Φ pentru a provoca modificări celulare majore.
De la monocit la M Φ În procesul de transformare, fenotip specific M Φ.În ultimii zece ani a fost dezvoltat un model care integrează M Φ Mecanismul complex de activare este descris ca polarizarea a două stări opuse: M Φ Fenotip 1 (M Φ 1, Activare clasică) și M Φ Fenotip 2 (M Φ). 2, activare alternativă).MΦ1 este caracterizat prin secreție inflamatorie de citokine (IFN-γ) și oxid nitric pentru a produce un mecanism eficient de ucidere a agentului patogen.M Φ Fenotipul produce, de asemenea, factorul de creștere endotelial vascular (VEGF) și factorul de creștere a fibroblastelor (FGF).M Φ Fenotipul este compus din celule antiinflamatorii cu fagocitoză ridicată.M Φ 2 Produce componente ale matricei extracelulare, angiogeneză și chemokine și interleukina 10 (IL-10).Pe lângă apărarea împotriva agenților patogeni, M Φ poate reduce, de asemenea, inflamația și promova repararea țesuturilor.Este de remarcat faptul că M Φ 2 a fost subdivizat în M in vitro Φ 2a、M Φ 2b și M Φ 2. Depinde de stimul.Traducerea in vivo a acestor subtipuri este dificilă deoarece țesutul poate conține grupuri M Φ mixte.Interesant, pe baza semnalelor locale de mediu și a nivelurilor IL-4, M Φ 1 proinflamator poate fi convertit pentru a promova repararea M Φ 2。 Din aceste date, este rezonabil să presupunem că există concentrații mari de monocite și preparate M Φ C-PRP. pot contribui la o mai bună reparare a țesuturilor deoarece au capacități de reparare a țesuturilor antiinflamatorii și de transducție a semnalului celular.
Definiție confuză a fracției de celule albe din sânge în PRP
Prezența globulelor albe în flacoanele de tratament cu PRP depinde de dispozitivul de preparare a PRP și poate avea diferențe semnificative.Există multe dispute cu privire la existența leucocitelor și contribuția lor la diferite produse sub-PRP (cum ar fi PRGF, P-PRP, LP-PRP, LR-PRP, P-PRF și L-PRF) Într-o revizuire recentă, șase randomizate studiile controlate (nivelul de dovezi 1) și trei studii comparative prospective (nivelul de dovezi 2) au implicat 1055 de pacienți, indicând că LR-PRP și LP-PRP au avut siguranță similară.Autorul a concluzionat că reacția adversă a PRP poate să nu fie direct legată de concentrația de celule albe din sânge.Într-un alt studiu, LR-PRP nu a modificat interleukina inflamatorie (IL-1) în genunchi OA β、 IL-6, IL-8 și IL-17).Aceste rezultate susțin opinia că rolul leucocitelor în activitatea biologică a PRP in vivo poate proveni din diafonia dintre trombocite și leucocite.Această interacțiune poate promova biosinteza altor factori (cum ar fi lipoxigenul), care pot compensa sau promova regresia inflamației.După eliberarea inițială a moleculelor inflamatorii (acid arahidonic, leucotrienă și prostaglandine), lipoxigenul A4 este eliberat din trombocitele activate pentru a preveni activarea neutrofilelor.În acest mediu, fenotipul M Φ de la M Φ 1 Trece la M Φ 2。 În plus, există tot mai multe dovezi că celulele mononucleare circulante se pot diferenția într-o varietate de tipuri de celule nefagocitare datorită pluripotenței lor.
Tipul de PRP va afecta cultura MSC.În comparație cu probele de PRP sau PPP pur, LR-PRP poate induce o proliferare semnificativ mai mare a MSC-urilor derivate din măduva osoasă (BMMSC), cu eliberare mai rapidă și activitate biologică mai bună a PGF.Toate aceste caracteristici sunt favorabile pentru adăugarea monocitelor în sticla de tratament cu PRP și recunoașterea capacității lor imunomodulatoare și potențialului de diferențiere.
Reglarea imună congenitală și adaptivă a PRP
Cea mai cunoscută funcție fiziologică a trombocitelor este de a controla sângerarea.Ele se acumulează la locul afectarii țesuturilor și la vasele de sânge deteriorate.Aceste evenimente sunt cauzate de expresia integrinelor și selectinelor care stimulează aderența și agregarea trombocitelor.Endoteliul deteriorat agravează și mai mult acest proces, iar colagenul expus și alte proteine matricei subendoteliale promovează activarea profundă a trombocitelor.În aceste cazuri, a fost dovedit rolul important al interacțiunii dintre factorul von Willebrand (vWF) și glicoproteină (GP), în special GP-Ib.După activarea trombocitelor, trombocitele α-、 Dense, lizozomul și granulele T reglează exocitoza și își eliberează conținutul în mediul extracelular.
Moleculă de aderență a trombocitelor
Pentru a înțelege mai bine rolul PRP în țesuturile inflamatorii și trombocite în răspunsul imun, ar trebui să înțelegem cum diferiți receptori de suprafață plachetar (integrine) și molecule de adeziune a joncțiunii (JAM) și interacțiunile celulare pot iniția procese critice în imunitatea înnăscută și adaptativă.
Integrinele sunt molecule de aderență la suprafața celulară găsite în diferite tipuri de celule și exprimate în cantități mari pe trombocite.Integrinele includ a5b1, a6b1, a2b1 LFA-2, (GPIa/IIa) și aIIbb3 (GPIIb/IIIa).De obicei, ele există într-o stare statică și de afinitate scăzută.După activare, ei trec la starea de afinitate mare de legare a ligandului.Integrinele au diferite funcții asupra trombocitelor și participă la interacțiunea trombocitelor cu mai multe tipuri de globule albe, celule endoteliale și matrice extracelulară.În plus, complexul GP-Ib-V-IX este exprimat pe membrana trombocitară și este principalul receptor pentru legarea cu von vWF.Această interacțiune mediază contactul inițial dintre trombocite și structurile subendoteliale expuse.Integrina trombocitară și complexul GP sunt legate de diferite procese inflamatorii și joacă un rol important în formarea complexului trombocite-leucocite.În mod specific, integrina aIIbb3 este necesară pentru a forma un complex stabil prin combinarea fibrinogenului cu receptorul antigenului macrofag 1 (Mac-1) pe neutrofile.
Trombocitele, neutrofilele și celulele endoteliale vasculare exprimă molecule specifice de adeziune celulară, numite selectină.În condiții inflamatorii, trombocitele exprimă P-selectină și L-selectina neutrofilă.După activarea trombocitelor, P-selectina se poate lega de ligandul PSGL-1 care există pe neutrofile și monocite.În plus, legarea PSGL-1 inițiază reacția în cascadă a semnalului intracelular, care activează neutrofilele prin integrina neutrofilă Mac-1 și antigenul 1 legat de funcția limfocitelor (LFA-1).Mac-1 activat se leagă de GPIb sau GPIIb/IIIa pe trombocite prin fibrinogen, stabilizând astfel interacțiunea dintre neutrofile și trombocite.În plus, LFA-1 activat se poate combina cu molecula 2 de adeziune intercelulară a trombocitelor pentru a stabiliza și mai mult complexul neutrofil-trombocite pentru a promova aderența pe termen lung cu celulele.
Trombocitele și leucocitele joacă un rol cheie în răspunsurile imune înnăscute și adaptative
Corpul poate recunoaște corpurile străine și țesuturile rănite în bolile acute sau cronice pentru a iniția reacția în cascadă de vindecare a rănilor și calea inflamatorie.Sistemul imunitar înnăscut și adaptiv protejează gazda de infecții, iar celulele albe din sânge joacă un rol important în suprapunerea între cele două sisteme.Mai exact, monocitele, macrofagele, neutrofilele și celulele natural killer joacă un rol cheie în sistemul înnăscut, în timp ce limfocitele și subseturile lor joacă un rol similar în sistemul imunitar adaptativ.
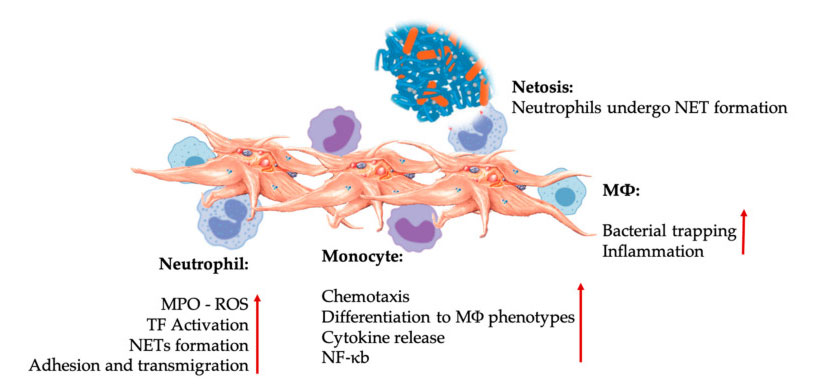
Interacțiunile trombocitelor și leucocitelor în interacțiunile celulelor imune înnăscute.Trombocitele interacționează cu neutrofilele și monocitele, iar în final cu M Φ Interacționează, ajustează și măresc funcțiile efectoare ale acestora.Aceste interacțiuni trombocite-leucocite duc la inflamație prin diferite mecanisme, inclusiv NEToza.Abrevieri: MPO: mieloperoxidază, ROS: specii reactive de oxigen, TF: factor de țesut, NET: capcană extracelulară pentru neutrofile, NF-κ B: factor nuclear kappa B, M Φ: Macrofage.
Sistemul imunitar înnăscut
Rolul sistemului imunitar înnăscut este de a identifica nespecific microorganismele invazive sau fragmentele de țesut și de a stimula eliminarea acestora.Atunci când anumite structuri moleculare numite receptori de recunoaștere a modelului de expresie de suprafață (PRR) se combină cu modele moleculare legate de patogen și modele moleculare legate de leziuni, sistemul imunitar înnăscut va fi activat.Există multe tipuri de PRR, inclusiv Toll-like receptor (TLR) și RIG-1 like receptor (RLR).Acești receptori pot activa principalul factor de transcripție kappa B (NF-κ B). De asemenea, reglează multiple aspecte ale răspunsului imun înnăscut și adaptiv.Interesant este că trombocitele exprimă, de asemenea, o varietate de molecule de receptor imunoregulatori pe suprafața și citoplasma lor, cum ar fi P-selectina, ligandul CD40 al proteinei transmembranare (CD40L), citokinele (cum ar fi IL-1 β、 TGF-β) și TLR-specific trombocitelor. Prin urmare, trombocitele pot interacționa cu diferite celule ale sistemului imunitar.
Interacțiunea trombocite-celule albe în imunitatea înnăscută
Când trombocitele intră sau invadează fluxul sanguin sau țesutul, trombocitele sunt una dintre celulele care detectează mai întâi leziunile endoteliale și agenții patogeni microbieni.Agregarea trombocitară și promovează eliberarea de agonişti plachetari ADP, trombină și vWF, ducând la activarea trombocitelor și la exprimarea receptorilor de chemokine plachetare C, CC, CXC și CX3C, provocând astfel trombocite în locul infectat sau leziuni.
Sistemul imunitar înnăscut este predeterminat genetic pentru a detecta invadatorii, cum ar fi viruși, bacterii, paraziți și toxine, sau răni și răni ale țesuturilor.Este un sistem nespecific, deoarece orice agent patogen va fi identificat ca fiind străin sau non-self și localizat rapid.Sistemul imunitar înnăscut se bazează pe un set de proteine și fagocite, care recunosc caracteristicile bine conservate ale agenților patogeni și activează rapid răspunsul imun pentru a ajuta la eliminarea invadatorilor, chiar dacă gazda nu a mai fost niciodată expusă la anumiți patogeni.
Neutrofilele, monocitele și celulele dendritice sunt cele mai comune celule imune înnăscute din sânge.Recrutarea lor este necesară pentru un răspuns imun timpuriu adecvat.Când PRP este utilizat în medicina regenerativă, interacțiunea trombocite-celule albe reglează inflamația, vindecarea rănilor și repararea țesuturilor.TLR-4 pe trombocite stimulează interacțiunea trombocite-neutrofile, care reglează așa-numita explozie oxidativă a leucocitelor prin reglarea eliberării speciilor reactive de oxigen (ROS) și a mieloperoxidazei (MPO) din neutrofile.În plus, interacțiunea dintre degranularea trombocitelor-neutrofile și neutrofile duce la formarea de capcane neutrofile-extracelulare (NET).NET-urile sunt compuse din nucleu neutrofile și alte conținuturi intracelulare de neutrofile, care pot captura bacteriile și le pot ucide prin NEToză.Formarea NET-urilor este un mecanism esențial de distrugere a neutrofilelor.
După activarea trombocitelor, monocitele pot migra către țesuturile bolnave și degenerative, unde desfășoară activități de adeziune și secretă molecule inflamatorii care pot modifica chimiotaxia și proprietățile proteolitice.În plus, trombocitele pot induce activarea monocitelor NF-κ B pentru a regla funcția efectoră a monocitelor, care este mediatorul cheie al răspunsului inflamator și al activării și diferențierii celulelor imune.Trombocitele promovează în continuare explozia oxidativă endogenă a monocitelor pentru a promova distrugerea agenților patogeni fagocitari.Eliberarea de MPO este mediată de interacțiunea directă dintre CD40L-MAC-1 trombocitar-monocit.Interesant este că atunci când P-selectina activează trombocitele în condiții de țesut inflamator acut și cronic, chemokinele derivate din trombocite PF4, RANTES, IL-1 β și CXCL-12 pot preveni apoptoza spontană a monocitelor, dar promovează diferențierea lor în macrofage.
Sistem imunitar adaptativ
După ce sistemul imunitar înnăscut nespecific recunoaște leziunile microbiene sau tisulare, sistemul imunitar adaptiv specific va prelua.Sistemele adaptive includ limfocitele B care leagă antigenul (celule B) și limfocitele T convenționale (Treg) care coordonează eliminarea agenților patogeni.Celulele T pot fi împărțite aproximativ în celule T helper (celule Th) și celule T citotoxice (celule Tc, cunoscute și ca celule T ucigașe).Celulele Th sunt în continuare împărțite în celule Th1, Th2 și Th17, care au funcții cheie în inflamație.Celulele Th pot secreta citokine proinflamatorii (de ex. IFN-γ、 TNF-β) și mai multe interleukine (de exemplu, IL-17). Sunt deosebit de eficiente în prevenirea infecțiilor virale intracelulare și bacteriene. Celulele Th stimulează proliferarea și diferențierea celulelor implicate în răspunsul imun.Celulele Tc sunt celule efectoare, care pot elimina microorganismele și celulele intracelulare și extracelulare vizate.
Interesant este că celulele Th2 produc IL-4 și afectează polarizarea M Φ, Fenotipul M Φ 2 regenerarea ghidată M Φ, în timp ce IFN-γ M Φ se schimbă la fenotipul inflamator M Φ 1, care depinde de doza și timpul de citokine.După activarea IL-4, M Φ2 induce celulele Treg să se diferențieze în celule Th2 și apoi produce IL-4 suplimentară (bucla de feedback pozitiv).Celulele Th convertesc M Φ Fenotipul este direcționat către fenotipul regenerativ ca răspuns la agenții biologici de origine tisulară.Acest mecanism se bazează pe dovezile că celulele Th joacă un rol semnificativ în controlul inflamației și repararea țesuturilor.
Interacțiunea trombocite-celule albe în imunitatea adaptivă
Sistemul imunitar adaptiv folosește receptori specifici antigenului și își amintește agenții patogeni întâlniți anterior și îi distruge atunci când întâlnește ulterior gazda.Cu toate acestea, aceste răspunsuri imune adaptative s-au dezvoltat lent.Konias și colab.Acesta arată că componenta trombocitară contribuie la percepția riscului și la repararea țesuturilor și că interacțiunea dintre trombocite și leucocite promovează activarea răspunsului imun adaptativ.
În timpul răspunsului imun adaptiv, trombocitele promovează răspunsurile monocitelor și macrofagelor prin maturarea celulelor DC și NK, conducând la răspunsuri specifice celulelor T și B.Prin urmare, componentele granulelor plachetare afectează direct imunitatea adaptivă prin exprimarea CD40L, o moleculă care este esențială pentru reglarea răspunsului imun adaptativ.Trombocitele prin CD40L nu numai că joacă un rol în prezentarea antigenului, ci afectează și reacția celulelor T.Liu și colab.S-a descoperit că trombocitele reglează răspunsul celulelor T CD4 într-un mod complex.Această reglare diferențială a subgrupurilor de celule T CD4 înseamnă că trombocitele promovează celulele T CD4 să răspundă la stimuli inflamatori, producând astfel răspunsuri proinflamatorii și antiinflamatorii puternice.
Trombocitele reglează, de asemenea, răspunsul adaptativ mediat de celulele B la agenții patogeni microbieni.Este bine cunoscut faptul că CD40L pe celulele T CD4 activate va declanșa CD40 ale celulelor B, furnizând al doilea semnal necesar pentru activarea limfocitelor B dependente de celulele T, conversia ulterioară a alotipului și diferențierea și proliferarea celulelor B.În general, rezultatele arată în mod clar diferitele funcții ale trombocitelor în imunitatea adaptivă, indicând faptul că trombocitele conectează interacțiunea dintre celulele T și celulele B prin CD40-CD40L, sporind astfel răspunsul celulelor B dependent de celulele T.În plus, trombocitele sunt bogate în receptori de suprafață celulară, care pot promova activarea trombocitelor și pot elibera un număr mare de molecule active inflamatorii și biologice stocate în diferite particule plachetare, afectând astfel răspunsul imun înnăscut și adaptativ.
Rolul extins al serotoninei derivate din trombocite în PRP
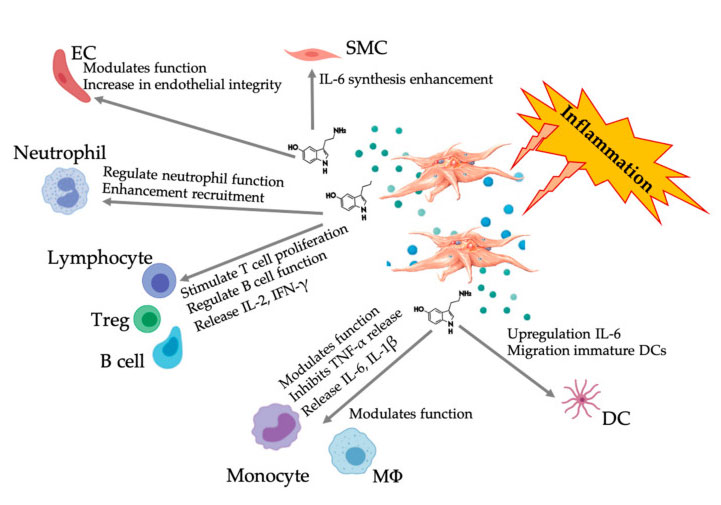
Serotonina (5-hidroxitriptamina, 5-HT) are un rol cheie clar în sistemul nervos central (SNC), inclusiv toleranța la durere.Se estimează că cea mai mare parte a 5-HT umană este produsă în tractul gastrointestinal și apoi prin circulația sângelui, unde este absorbită de trombocite prin transportorul de recaptare a serotoninei și stocată în particule dense la concentrație mare (65 mmol/L).5-HT este un neurotransmițător și hormon bine-cunoscut care ajută la reglarea diferitelor procese neuropsihologice din SNC (5-HT central).Cu toate acestea, cea mai mare parte a 5-HT există în afara SNC (5-HT periferic) și este implicată în reglarea funcțiilor biologice sistemice și celulare ale mai multor sisteme de organe, inclusiv sistemele cardiovasculare, pulmonare, gastrointestinale, urogenitale și trombocite.5-HT are un metabolism dependent de concentrație pe o varietate de tipuri de celule, inclusiv adipocite, celule epiteliale și celule albe din sânge.5-HT periferic este, de asemenea, un modulator imunitar puternic, care poate stimula sau inhiba inflamația și poate afecta diferite celule imunitare prin receptorul său specific 5-HT (5HTR).
Mecanismul paracrin și autocrin al HT
Activitatea 5-HT este mediată de interacțiunea sa cu 5HTR, care este o superfamilie cu șapte membri (5-HT 1 – 7) și cel puțin 14 subtipuri de receptori diferite, inclusiv membrul recent descoperit 5-HT 7, periferic și funcția în managementul durerii.În procesul de degranulare a trombocitelor, trombocitele activate secretă un număr mare de 5-HT derivat din trombocite, care poate promova contracția vasculară și poate stimula activarea trombocitelor și limfocitelor adiacente prin expresia 5-HTR pe celulele endoteliale, celulele musculare netede și celule ale sistemului imunitar.Pacala et al.A fost studiat efectul mitotic al 5-HT asupra celulelor endoteliale vasculare și a fost determinat potențialul de a promova creșterea vaselor de sânge deteriorate prin stimularea angiogenezei.Modul în care aceste procese sunt reglementate nu este complet clar, dar poate implica căi de semnal diferențiale în două sensuri în microcircuitul tisular pentru a regla funcțiile celulelor endoteliale vasculare și ale celulelor musculare netede, fibroblastelor și celulelor imune prin receptori specifici 5-HT de pe aceste celule. .Funcția autocrină a trombocitelor 5-HT după activarea trombocitelor a fost descrisă [REF].Eliberarea de 5-HT îmbunătățește activarea trombocitelor și recrutarea trombocitelor circulante, ducând la activarea reacțiilor în cascadă de semnal și a efectorilor din amonte care susțin reactivitatea trombocitelor.
Efect imunomodulator 5-HT
Din ce în ce mai multe dovezi arată că serotonina poate juca un rol în diferite 5HTR ca modulator imun.Conform 5HTR-ului exprimat în diferite leucocite implicate în reacția inflamatorie, 5-HT derivat din trombocite acționează ca un regulator imunitar atât în sistemul imunitar înnăscut, cât și în cel adaptiv.5-HT poate stimula proliferarea Treg și poate regla funcțiile celulelor B, celulelor ucigașe naturale și neutrofilelor prin recrutarea DC și monocite la locul inflamator.Studii recente au arătat că 5-HT derivat din trombocite poate regla funcția celulelor imune în condiții specifice.Prin urmare, folosind C-PRP, concentrația de trombocite este mai mare de 1 × 10 6/µ L poate ajuta în mod semnificativ la transportul concentrației de 5-HT derivat din trombocite mari către țesut.În micromediul caracterizat prin componente inflamatorii, PRP poate interacționa cu mai multe celule imunitare care joacă un rol cheie în aceste patologii, care pot afecta rezultatele clinice.
Figura care afișează răspunsul 5-HT cu mai multe fațete după activarea trombocitelor PRP inflamatorii.După activarea trombocitelor, trombocitele își eliberează granulele, inclusiv 5-HT în granule dense, care are o gamă largă de efecte diferențiale asupra diferitelor celule imunitare, celule endoteliale și celule musculare netede.Abrevieri: SMC: celule musculare netede, EC: celule endoteliale, Treg: limfocite T convenționale, M Φ: Macrofage, DC: celule dendritice, IL: interleukină, IFN-γ: Interferon γ。 Modificat și adaptat de la Everts și colab.şi Hull şi colab.
Efectul analgezic al PRP
Trombocitele activate vor elibera mulți mediatori proinflamatori și antiinflamatori, care nu numai că pot provoca durere, ci și pot reduce inflamația și durerea.Odată aplicată, dinamica plachetară tipică a PRP modifică micromediul înainte de repararea și regenerarea țesuturilor printr-o varietate de căi complexe legate de anabolism și catabolism, proliferarea celulară, diferențierea și reglarea celulelor stem.Aceste caracteristici ale PRP duc la aplicarea PRP în diferite afecțiuni clinice patologice asociate de obicei cu durere cronică (cum ar fi leziuni sportive, boli ortopedice, boli ale coloanei vertebrale și plăgi cronice complexe), deși mecanismul exact nu a fost pe deplin determinat.
În 2008, Evertz et al.Este primul studiu controlat randomizat care raportează efectul analgezic al preparatului PRP, care este preparat din stratul maro al vitezei de sedimentare a eritrocitelor autologe și activat cu trombină autologă după intervenția chirurgicală la umăr.Ei au observat o reducere semnificativă a scorurilor la scara analogică vizuală, utilizarea analgezicelor pe bază de opioide și o reabilitare postoperatorie mai reușită.Este de remarcat faptul că acestea reflectă efectul analgezic al trombocitelor activate și speculează asupra mecanismului de eliberare a trombocitelor 5-HT.Pe scurt, trombocitele sunt latente în PRP proaspăt preparat.După activarea trombocitelor direct sau indirect (factor tisular), trombocitele își schimbă forma și produc suficient de false pentru a favoriza agregarea trombocitară.Apoi, eliberează particule α- și dense intracelulare.Țesutul tratat cu PRP activat va fi invadat de PGF, citokine și alți lizozomi plachetari.Mai precis, atunci când particulele dense își eliberează conținutul, ele vor elibera o cantitate mare de 5-HT care reglează durerea.În C-PRP, concentrația de trombocite este de 5 până la 7 ori mai mare decât cea din sângele periferic.Prin urmare, eliberarea de 5-HT din trombocite este astronomică.Interesant este că Sprott și colab.Raportul a observat că durerea a fost ameliorată semnificativ după acupunctură și moxibustie, concentrația de 5-HT derivat din trombocite a fost redusă semnificativ și apoi nivelul plasmatic de 5-HT a fost crescut.
În periferie, trombocitele, mastocitele și celulele endoteliale vor elibera 5-HT endogen în timpul leziunii tisulare sau a traumei chirurgicale.Interesant este că o varietate de receptori 5-HT ai neuronilor au fost detectați în zona periferică, ceea ce a confirmat că 5-HT poate interfera cu transmiterea nociceptivă în zona periferică.Aceste studii arată că 5-HT poate afecta transmiterea nociceptivă a țesuturilor periferice prin receptorii 5-HT1, 5-HT2, 5-HT3, 5-HT4 și 5-HT7.
Sistemul 5-HT reprezintă un sistem puternic care poate reduce și crește gradul de durere după stimularea dăunătoare.Reglarea centrală și periferică a semnalelor nociceptive și modificări ale sistemului 5-HT au fost raportate la pacienții cu durere cronică.În ultimii ani, un număr mare de studii s-au concentrat asupra rolului 5-HT și al receptorilor săi respectivi în procesarea și reglarea informațiilor dăunătoare, rezultând medicamente precum inhibitorii selectivi ai recaptării serotoninei (SSRI).Acest medicament inhibă recaptarea serotoninei în neuronii presinaptici după eliberarea serotoninei.Afectează durata și intensitatea comunicării serotoninei și este un tratament alternativ pentru durerea cronică.Sunt necesare cercetări clinice suplimentare pentru a înțelege în mod clar mecanismul molecular al reglării durerii 5-HT derivate din PRP în bolile cronice și degenerative.
Alte date pentru a rezolva efectul analgezic potențial al PRP pot fi obținute după testul analgezic pe model animal.Concluziile statistice comparative din aceste modele sunt provocatoare, deoarece aceste studii conțin prea multe variabile.Cu toate acestea, unele studii clinice au abordat efectele nociceptive și analgezice ale PRP.Mai multe studii au arătat că pacienții care primesc tratament pentru tendinoză sau rupturi ale manșetei rotatorilor au puțină ameliorare a durerii.În schimb, alte câteva studii au arătat că PRP poate reduce sau chiar elimina durerea pacienților cu degenerare a tendonului, OA, fasciită plantară și alte boli ale piciorului și gleznei.Concentrația finală de trombocite și compoziția celulelor biologice au fost identificate ca fiind caracteristicile cheie ale PRP, care ajută la observarea efectului analgezic consistent după aplicarea PRP.Alte variabile includ metoda de eliberare a PRP, tehnologia de aplicare, protocolul de activare a trombocitelor, nivelul de activitate biologică a PGF și citokinele eliberate, tipul de țesut de aplicare a PRP și tipul de leziune.
Este de remarcat faptul că Kuffler a rezolvat potențialul PRP în atenuarea durerii la pacienții cu durere neuropatică cronică ușoară până la severă, secundară nervului neregenerativ deteriorat.Scopul acestui studiu este de a investiga dacă durerea neuropatică poate fi redusă sau atenuată datorită PRP care promovează regenerarea axonală și reinervarea nervului țintă.În mod surprinzător, printre pacienții care primesc tratament, durerea neuropatică este încă eliminată sau atenuată la cel puțin șase ani după operație.În plus, toți pacienții au început să amelioreze durerea în trei săptămâni după aplicarea PRP.
Recent, efecte analgezice similare PRP au fost observate în domeniul rănilor postoperatorii și al îngrijirii pielii.În mod interesant, autorii au raportat aspectele fiziologice ale durerii rănilor asociate cu leziuni vasculare și hipoxia țesutului pielii.Ei au discutat, de asemenea, despre importanța angiogenezei în optimizarea oxigenării și a livrării de nutrienți.Studiul lor a arătat că, în comparație cu grupul de control, pacienții care au primit tratament PRP au avut mai puțină durere și au crescut semnificativ angiogeneza.În cele din urmă, Johal și colegii săi au efectuat o revizuire sistematică și o meta-analiză și au concluzionat că PRP poate reduce durerea după utilizarea PRP în indicații ortopedice, în special la pacienții care primesc epicondilita externă și tratament cu OA a genunchiului.Din păcate, acest studiu nu a specificat efectele celulelor albe din sânge, concentrația trombocitelor sau utilizarea activatorilor exogeni ai trombocitelor, deoarece aceste variabile ar afecta eficacitatea globală a PRP.Concentrația optimă de trombocite PRP pentru ameliorarea maximă a durerii este neclară.În modelul de tendinoză de șobolan, concentrația de trombocite a fost de 1,0 × 10 6 / μ La L, durerea poate fi complet atenuată, în timp ce ameliorarea durerii cauzată de PRP cu jumătate din concentrația de trombocite este redusă semnificativ.Prin urmare, încurajăm mai multe studii clinice pentru a investiga efectele analgezice ale diferitelor preparate PRP.
PRP și efect de angiogeneză
Preparatele C-PRP în medicina regenerativă precisă permit livrarea de biomolecule eliberate de concentrații mari de trombocite activate la locurile țesutului țintă.Prin urmare, au fost inițiate o varietate de reacții în cascadă, care contribuie la reglarea imună la fața locului, procesul inflamator și angiogeneza pentru a promova vindecarea și repararea țesuturilor.
Angiogeneza este un proces dinamic în mai multe etape care implică germinația și microvasele tisulare din vasele de sânge preexistente.Angiogeneza a progresat datorită unei varietăți de mecanisme biologice, inclusiv migrarea celulelor endoteliale, proliferarea, diferențierea și diviziunea.Aceste procese celulare sunt premise pentru formarea de noi vase de sânge.Ele sunt esențiale pentru creșterea vaselor de sânge preexistente pentru a restabili fluxul sanguin și pentru a susține activitatea metabolică ridicată de reparare și regenerare a țesuturilor.Aceste noi vase de sânge permit livrarea de oxigen și nutrienți și eliminarea subproduselor din țesuturile tratate.
Activitatea angiogenezei este reglată prin stimularea factorului angiogenic VEGF și a factorilor antiangiogenici (de exemplu, angiostatina și trombospondin-1 [TSP-1]).În micromediul bolnav și degradat (inclusiv tensiune scăzută a oxigenului, pH scăzut și nivel ridicat de acid lactic), factorii angiogeni locali vor restabili activitatea angiogenezei.
Mai multe medii solubile în trombocite, cum ar fi FGF bazic și TGF-β și VEGF pot stimula celulele endoteliale să producă noi vase de sânge.Landsdown și Fortier au raportat diferite rezultate legate de compoziția PRP, inclusiv sursele intraplachetare ale multor regulatori angiogenici.În plus, ei au concluzionat că creșterea angiogenezei contribuie la vindecarea bolii MSK în zonele cu vascularizare slabă, cum ar fi ruptura de menisc, leziuni ale tendonului și alte zone cu vascularizare slabă.
Proprietăți de promovare și anti-angiogene plachetare
În ultimele câteva decenii, studiile publicate au demonstrat că trombocitele joacă un rol cheie în hemostaza primară, formarea cheagurilor, factorul de creștere și eliberarea de citokine și reglarea angiogenezei ca parte a procesului de reparare a țesuturilor.În mod paradoxal, PRP α- granulele conțin un arsenal de factori de creștere pro-angiogeni, proteine anti-angiogenice și citokine (cum ar fi PF4, inhibitorul activatorului de plasminogen-1 și TSP-1) și vizează eliberarea de factori specifici care joacă un rol. .Rolul în angiogeneză.Prin urmare, rolul PRP în controlul reglării angiogenezei poate fi definit prin activarea receptorilor specifici de suprafață celulară, TGF-β Inițiază reacții pro-angiogene și anti-angiogene.Capacitatea trombocitelor de a exercita calea angiogenezei a fost confirmată în angiogeneza patologică și angiogeneza tumorală.
Factorul de creștere angiogenic derivat din trombocite și factorul de creștere antiangiogenic, derivat din molecule α- Și dense și adezive.Cel mai important, este în general acceptat că efectul global al trombocitelor asupra angiogenezei este pro-angiogenic și stimulator.Este de așteptat ca terapia cu PRP să controleze inducerea angiogenezei, care va contribui la efectul de tratament al multor boli, cum ar fi vindecarea rănilor și repararea țesuturilor.Administrarea PRP, mai precis administrarea de concentrație mare de PGF și alte citokine plachetare, poate induce angiogeneza, angiogeneza și arteriogeneza, deoarece factorul 1a derivat din celulele stromale se leagă de receptorul CXCR4 de pe celulele progenitoare endoteliale.Bill și colab.Se sugerează că PRP crește neovascularizarea ischemică, care se poate datora stimulării angiogenezei, angiogenezei și arteriogenezei.În modelul lor in vitro, proliferarea celulelor endoteliale și formarea capilare au fost induse de un număr mare de PDG-uri diferite, dintre care VEGF a fost principalul stimulator angiogenic.Un alt factor important și esențial pentru restabilirea căii angiogenezei este sinergia dintre multiple PGF.Richardson şi colab.S-a dovedit că activitatea sinergică a factorului angiogenic factor de creștere derivat din trombocite-bb (PDGF-BB) și VEGF a condus la formarea rapidă a rețelei vasculare mature în comparație cu activitatea factorului de creștere individual.Efectul combinat al acestor factori a fost confirmat recent într-un studiu privind îmbunătățirea circulației colaterale cerebrale la șoareci cu hipoperfuzie pe termen lung.
Cel mai important, un studiu in vitro a măsurat efectul proliferativ al celulelor endoteliale ale venei ombilicale umane și al diferitelor concentrații de trombocite asupra selecției dispozitivului de preparare a PRP și a strategiei de dozare a trombocitelor, iar rezultatele au arătat că doza optimă de trombocite a fost de 1,5 × 106 trombocite/μ. 50. Pentru a promova angiogeneza.Concentrația prea mare de trombocite poate inhiba procesul de angiogeneză, deci efectul este slab.
Îmbătrânirea celulară, îmbătrânirea și PRP
Senescența celulară poate fi indusă de diverși stimuli.Acesta este un proces în care celulele se opresc din diviziunea și suferă modificări fenotipice unice pentru a preveni creșterea nerestricționată a celulelor deteriorate, care joacă un rol important în prevenirea cancerului.În procesul de îmbătrânire fiziologică, îmbătrânirea prin replicare celulară va promova și îmbătrânirea celulară, iar capacitatea de regenerare a MSC-urilor va fi redusă.
Efectele îmbătrânirii și îmbătrânirii celulare
In vivo, multe tipuri de celule se vor îmbătrâni și se vor acumula în diferite țesuturi în timpul îmbătrânirii, printre care există un număr mare de celule îmbătrânite.Acumularea de celule îmbătrânite pare să crească odată cu creșterea în vârstă, deteriorarea sistemului imunitar, deteriorarea țesuturilor sau factorii legați de stres.Mecanismul îmbătrânirii celulare a fost identificat ca factorul patogen al bolilor legate de vârstă, cum ar fi osteoartrita, osteoporoza și degenerarea discului intervertebral.O varietate de stimuli vor agrava îmbătrânirea celulară.Ca răspuns, fenotipul secretor legat de senescență (SASP) va secreta concentrații mari de celule proteice și citokine.Acest fenotip special este legat de celulele îmbătrânite, în care ele secretă niveluri ridicate de citokine inflamatorii (cum ar fi IL-1, IL-6, IL-8), factori de creștere (cum ar fi TGF-β、 HGF, VEGF, PDGF), MMP și catepsină.În comparație cu tinerii, s-a dovedit că SAPS crește odată cu vârsta, deoarece procesul de stare de echilibru este distrus, ducând la îmbătrânirea celulară și capacitatea de regenerare redusă.Mai exact, în bolile articulare și afecțiunile mușchilor scheletici.În acest sens, îmbătrânirea imună este considerată a fi o schimbare semnificativă în spectrul de secreție al celulelor imune, indicând faptul că concentrația de TNF-a, IL-6 și/sau Il-1b crește, ceea ce duce la inflamație cronică de grad scăzut.Este de remarcat faptul că disfuncția celulelor stem este, de asemenea, legată de mecanisme autonome non-celulare, cum ar fi celulele îmbătrânite, în special producția de factori proinflamatori și anti-regenerativi prin SASP.
Dimpotrivă, SASP poate stimula, de asemenea, plasticitatea celulară și reprogramarea celulelor adiacente.În plus, SASP poate organiza comunicarea cu diverși mediatori imuni și poate activa celulele imune pentru a promova clearance-ul celulelor îmbătrânite.Înțelegerea rolului și funcției celulelor îmbătrânite va contribui la vindecarea și remodelarea tisulară a mușchilor MSK și a rănilor cronice.
Este de remarcat faptul că Ritcka et al.A fost realizat un studiu amplu și a fost descoperit rolul principal și benefic al SASP în promovarea plasticității celulare și regenerarea țesuturilor și a fost introdus conceptul de livrare tranzitorie a celulelor îmbătrânite.Ei au menționat cu precauție că îmbătrânirea este în principal un proces benefic și regenerator.
Îmbătrânirea celulară și potențialul PRP
Pe măsură ce numărul de celule stem scade, îmbătrânirea va afecta performanța celulelor stem.În mod similar, la om, caracteristicile celulelor stem (cum ar fi uscăciunea, proliferarea și diferențierea) scad, de asemenea, odată cu vârsta.Wang și Nirmala au raportat că îmbătrânirea ar reduce caracteristicile celulelor stem ale celulelor tendinoase și numărul de receptori ai factorilor de creștere.Un studiu pe animale a arătat că concentrația de PDGF la caii tineri a fost ridicată.Ei au ajuns la concluzia că creșterea numărului de receptori GF și a numărului de GF la indivizii tineri poate avea un răspuns celular mai bun la tratamentul cu PRP decât persoanele mai în vârstă la indivizii tineri.Aceste descoperiri dezvăluie de ce tratamentul cu PRP poate fi mai puțin eficient sau chiar ineficient la pacienții vârstnici cu mai puține celule stem și „de calitate slabă”.S-a dovedit că procesul de îmbătrânire a cartilajului de îmbătrânire este inversat și perioada de repaus a condrocitelor este crescută după injectarea PRP.Jia și colab.Este utilizat pentru a studia fotoîmbătrânirea in vitro a fibroblastelor dermice de șoarece, cu și fără tratament PRP, pentru a clarifica mecanismul de contracarare a PGF în acest model.Grupul PRP a arătat un efect direct asupra matricei extracelulare, a crescut colagenul de tip I și a scăzut sinteza metaloproteinazelor, indicând faptul că PRP poate contracara îmbătrânirea celulară și, de asemenea, în boala degenerativă MSK.
Într-un alt studiu, PRP a fost folosit pentru a colecta celule stem îmbătrânite din măduva osoasă de la șoareci în vârstă.S-a determinat că PRP poate recupera o varietate de funcții ale celulelor stem din îmbătrânire, cum ar fi proliferarea celulară și formarea de colonii, și poate reconstrui markerii legați de îmbătrânirea celulară.
Recent, Oberlohr și colegii săi au studiat pe larg rolul îmbătrânirii celulare în slăbirea regenerării musculare și au evaluat PRP și plasma săracă în trombocite (PPP) ca opțiuni de tratament biologic pentru repararea mușchilor scheletici.Ei au imaginat că tratamentul cu PRP sau PPP pentru repararea mușchilor scheletici se va baza pe factori biologici personalizați pentru markerii celulari specifici SASP și alți factori care duc la dezvoltarea fibrozei.
Este rezonabil să credem că înainte de aplicarea PRP, îmbătrânirea celulară țintită poate îmbunătăți caracteristicile de regenerare ale eficacității tratamentului biologic prin reducerea factorilor locali SASP.S-a sugerat că o altă opțiune de îmbunătățire a rezultatelor tratamentului cu PRP și PPP pentru regenerarea mușchilor scheletici este eliminarea selectivă a celulelor îmbătrânite cu ajutorul scavengers de îmbătrânire.Nu există nicio îndoială că rezultatele cercetărilor recente privind efectul PRP asupra îmbătrânirii și îmbătrânirii celulelor sunt fascinante, dar sunt încă în stadiul inițial.Prin urmare, este nerezonabil să faceți sugestii în acest moment.
(Conținutul acestui articol este retipărit și nu oferim nicio garanție expresă sau implicită pentru acuratețea, fiabilitatea sau completitudinea conținutului conținutului acestui articol și nu suntem responsabili pentru opiniile acestui articol, vă rugăm să înțelegeți.)
Ora postării: Mar-01-2023